V观财报|英力股份及2人被警示:内控制度不健全等
2023-12-27
更新时间:2023-12-27 18:38:33作者:橙橘网

(文/王力 编辑/徐喆)12月21日,商务部、科技部发布公布的《中国禁止出口限制出口技术目录》正式实施引起广泛关注。亮点在于,该目录新添了“用于人的细胞克隆和基因编辑技术”,将其列为禁止出口技术的范畴。
根据《目录》,对于“用于人的细胞克隆和基因编辑技术”的具体定义突显了其伦理争议和潜在严重危害。这些技术主要牵涉到对人体生殖细胞中的遗传物质进行编辑,包括但不限于胚胎细胞、卵子细胞和精子细胞。
值得一提的是,在2022年12月30日,商务部公布的修订版《中国禁止出口限制出口技术目录》征求意见稿中,就已经首次提及“用于人的细胞克隆和基因编辑技术”作为禁止出口技术。然而,今年的最终定义明显缩小了范围,呈现出更为明确的轮廓。
作为颇具前瞻性的技术,基因编辑和合成生物学一直是全球科技竞争的焦点。值得注意的是,美国曾在这两个领域进行技术封锁。新版目录的发布是否意味着新一轮的技术对抗,对于国内从事基因编辑和合成生物学的企业而言,是否将带来影响,一系列的问题在业内引发热议。
新《目录》禁止人体基因编辑技术出口
12月21日,商务部、科技部修订发布《中国禁止出口限制出口技术目录》(以下简称《目录》)。
商务部在面对媒体提问时表示,本次《目录》修订充分征求了相关部门、行业协会、业界学界和社会公众意见。这一调整是对2008年、2020年两次调整的延续,旨在适应技术发展变化,维护技术出口秩序。
具体来看,此次《目录》内公删减了34项技术条目,新增4项,修改37项。具体内容包括删除禁止出口的绿色植物生产调节剂制造技术等6项,以及限制出口的医用诊断器械及设备制造技术等28项。同时,新增了用于人的细胞克隆和基因编辑技术作为禁止出口技术,对37项技术条目的控制要点和技术参数也进行了调整。
关于技术出口,商务部表示将进一步优化管理措施,简化手续,提供更多公共服务,引导企业做好合规工作。
而这一调整将如何影响技术对抗升级、出口限制对领域投资的影响,成为业内关注的热点话题。
从新版《目录》来看,此次新增的用于人的细胞克隆和基因编辑技术具体解释为“具有伦理争议,且可产生重大危害,用于对含有遗传物质的人体生殖细胞(即胚胎细胞、卵子细胞、精子细胞)进行编辑的基因编辑技术”。
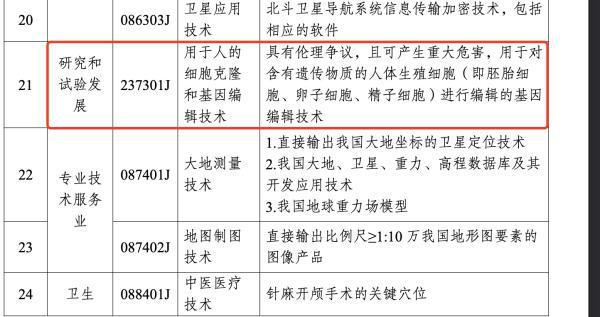
(截图来自中华人民共和国商务部官网)
具体而言,该限制适用于对含有遗传物质的人体生殖细胞,包括胚胎细胞、卵子细胞和精子细胞进行编辑的基因编辑技术。
业内人士认为,禁止出口用于人的细胞克隆和基因编辑技术的决策是基于对这些技术的伦理争议以及可能带来的重大危害的考量,而基因编辑技术是各国战略性新兴产业的主攻方向,对于抢占新一轮科技革命和产业革命制高点,加快壮大新产业、发展新经济、培育新动能,具有重要意义。
一直以来,为了占据产业高地,美国为保持其技术、科学等方面的领先地位,对中国高科技领域采取一系列管制措施。
2018年11月19日,美国商务部工业安全署出台了一份针对关键技术和相关产品的出口管制框架,该框架列示的首个管制领域即为生物技术,其中便包括合成生物学。根据美国商务部工业安全署官方披露数据显示,2019至2020年,美国先进生物技术出口至中国的金额由 22.85亿美元下降至18.51亿美元,下跌幅度达19%。《2021美国创新与竞争法案》中将合成生物学、生物科技、基因组学列入关键技术领域。
中美技术之争,国内企业影响几何?
从公司层面解读,这一限制可能使得企业面临更为严格的技术出口审批程序,需要履行更加复杂的手续。而于构造“细胞工厂”的企业而言,《目录》更新影响几何?
基因编辑(Gene Editing),又称基因组编辑(Genome Editing)或基因组工程(Genome Engineering),是一项精确的科学技术,可以对含有遗传信息的基因序列进行插入、删除、替换等进行修改。
基因序列改变有可能对蛋白质的表达造成影响,并且蛋白质的一个重要功能是调节生命活动,所以基因序列的改变甚至会影响整个生命体的生理生化活动。
目前,人体基因编辑可分为两个主要方向:一是编辑患者的体细胞,以治疗疾病;另一是编辑生殖细胞(精子、卵细胞或受精卵),旨在预防遗传疾病或增强某些功能。这两者的应用存在显著差异。
编辑患者体细胞的治疗方式是通过修改体细胞来治疗患者。这种治疗的目标是只影响接受治疗的个体,而不对其后代产生影响。
相比之下,生殖细胞编辑在胚胎形成过程中或之后进行基因改变,这可能在儿童细胞中(包括生殖细胞)产生影响。与体细胞编辑不同,经过生殖系编辑的人类可能将这些基因编辑传递给他们的后代,因此存在潜在的污染人类基因库的风险,因而这种技术目前未被广泛采用。
而对于基因编辑企业来说,此次《目录》的限制范围是基因编辑在具有伦理争议领域的应用,包括基因编辑胚胎细胞、卵子细胞、精子细胞和可造成重大危害后果的研究中的应用,当前国内大部分基因编辑企业都是编辑患者的体细胞以治疗疾病,并不涉及生殖细胞编辑,因此限制出口的影响有限。
从基因编辑产业链来看,上游为科研机构和高校,包括中科院生化交叉研究中心、哈佛大学、清华大学、北京大学等均为该领域的重要参与者,代表着国内外顶尖的科研水平。而设计基因编辑技术的企业大多为初创企业尚未登陆资本市场,管线研发也多在临床早期,除辉大基因外还包括瑞风生物、本导基因等。
在中游企业方面,产品供应商包括源井生物、信念医药、吉玛基因、诺唯赞等,而技术服务商包括九天生物、南模生物、博雅辑因等。这些企业在基因编辑领域扮演了关键的角色,通过提供产品和技术服务,支持上游科研机构和下游企业的需求。
下游CRO(临床研究外包)公司包括赛业生物、博腾生物、冠科生物等,而制药公司则有芳拓生物、凌意生物、纽福斯等。
“科学的前沿,伦理的边缘”,伦理审查成关键
从营收角度来看,我国基因编辑行业正处于发展前期阶段,但技术层面来看,中国的基因编辑并不算落后。
今年12月初,美国食品药品监督管理局(FDA)宣布批准两款CRISPR/Cas9基因编辑疗法上市,标志着基因编辑疗法正式迈入监管认可的药物领域。
业内普遍认为,这一天是基因编辑疗法的历史性时刻,这也标志着人类正式进入利用基因编辑治疗疾病的新时代。
这两款疗法分别是由福泰制药与CRISPR Therapeutics合作研发的Casgevy以及蓝鸟生物的Lyfgenia,获批用于治疗12岁及以上伴有复发性血管闭塞危象的镰状细胞病患者。
CRISPR-Cas9技术被称为是“上帝的剪刀”,其原理是利用一种特殊的酶簇,来精确地编辑DNA序列,然后通过细胞自身修复机制,实现插入、删除或修改特定基因,相对于传统的基因编辑技术,具有更高的效率和精确性。
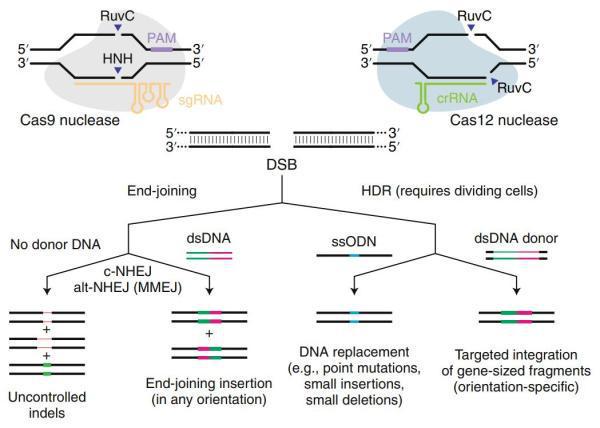
而反观国内,实则早在2016年7月,四川大学华西医院肿瘤学教授卢铀团队宣布将开展“全球第一例”CRISPR–Cas9基因编辑人体临床试验,同年10月28日,首名癌症患者接受了经CRISPR技术改造的T细胞治疗,中国也是第一个将CRISPR用于人体试验的国家。
近年来,我国也自主研发了基因编辑工具。2022年1月,辉大基因研发的CRISPR-Cas13 RNA编辑器系统-Cas13X和Cas13Y的底层专利就获得了美国专利商标局授权。这是我国首个自主研发的、在美国获得专利授权的CRISPR-Cas13基因编辑工具。
此后今年六月,辉大基因科学家团队自主开发的新型DNA编辑系统CRISPR-Cas12i(Cas12Max®)的美国发明专利US11,649,444B1,通过专利快速审查通道,在短短9个月内正式获得美国专利商标局(USPTO)授权,实现了中国首个CRISPR-Cas12i系统底层专利的海外布局突破。
当前,中美在基因编辑领域的竞争主要集中在临床试验伦理上,而在我国,关于基因编辑在临床试验中的具体操作一直存在争议。目前,我国的企业在临床试验中主要限于处理单一基因遗传病,而且更偏向于罕见病,而美国同行在治疗疾病的选择上则更为广泛。
CRISPR-Cas9技术系统虽然为基因编辑提供了便利,但它有时会在非目标位点上引发错误的DNA修复,导致基因序列意外变化,为临床治疗带来潜在风险。
除了技术层面的风险,CRISPR-Cas9技术也引发了基因编辑的伦理争议。通过基因编辑,我们有可能改变人类的遗传信息,甚至创造“设计婴儿”。这一技术是否应该用于人类胚胎的基因编辑引发了全球范围内的争议和道德观点的冲突。
基因编辑问题不仅仅是学术上的困扰,更是一个社会问题。在2022年发布的《关于加强科技伦理治理的意见》中,我国首次提出了基因编辑的道德伦理规范,将其纳入国家层面的治理框架。